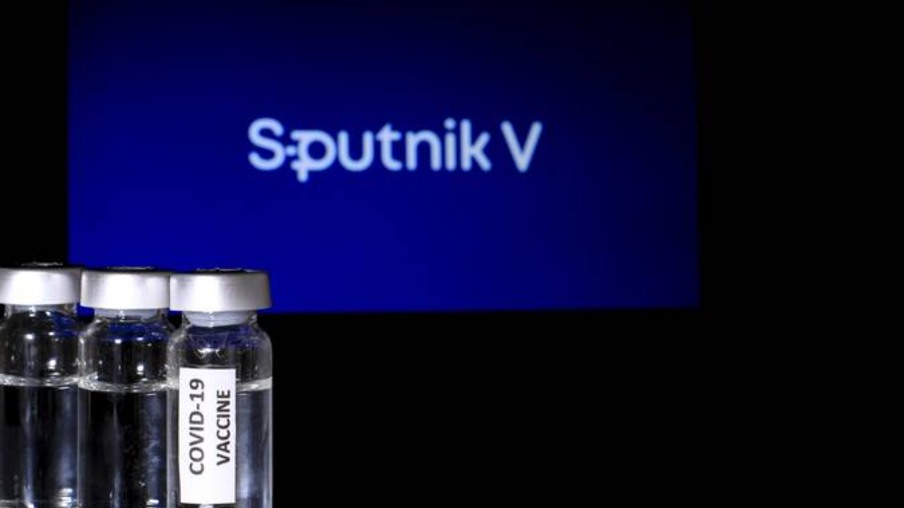
O gerente-geral de Medicamentos e Produtos Biológicos da Agência Nacional de Vigilância Sanitária (Anvisa), Gustavo Mendes Lima, disse hoje (27) ainda haver espaço para a aprovação e liberação da importação da vacina Sputnik V. Ontem (26), a agência reguladora rejeitou um pedido de nove estados, além do pedido de Niterói e Maricá para a aquisição da vacina, produzida pelo Instituto Gamaleya, da Rússia.
Ao barrar a entrada do imunizante, os diretores da Anvisa alegaram faltar dados técnicos e pendências na documentação apresentada pelo fabricante para verificar se a vacina é segura e eficaz e que, dessa forma, pode trazer riscos à saúde.
De acordo com o gerente-geral, a Anvisa pode rever a posição se conseguir acesso às informações técnicas que considera que faltam. Essa mudança pode ocorrer na avaliação de pedidos de importação pendente da Sputnik.
“Os pedidos de importação excepcional, os que não definimos ontem, estão em aberto e também o pedido para autorização para uso emergencial. Então, existe espaço para a entrada [da vacina]. As portas não estão fechadas. Além disso, toda as decisões da Anvisa são passíveis de recurso”, disse Mendes durante audiência na Câmara dos Deputados para debater a situação dos imunizantes no país.
Os pedidos barrados pela Anvisa foram para Bahia, Acre, Rio Grande do Norte, Maranhão, Mato Grosso, Piauí, Ceará, Sergipe, Pernambuco e Rondônia. Já os que estão pendentes de avaliação são para os estados de Sergipe, Tocantins, Amapá e Pará, e os municípios de Niterói (RJ) e Maricá (RJ). Ao todo, esses pedidos somam 66 milhões de doses, que poderiam vacinar cerca de 33 milhões de pessoas, por meio de duas doses.
Ausência do Instituto Gamaleya
Durante a audiência, marcada para ouvir representantes do Ministério da Saúde e dos laboratórios sobre a situação das vacinas Pfizer, Janssen e Sputnik V no país, deputados criticaram a ausência de representantes do Instituto Gamaleya. De acordo com o embaixador da Rússia, a representação do instituto não pode participar da audiência devido a reunião ter começado atrasada.
A deputada Jandira Feghali (PCdoB-RJ) disse ter ficado decepcionada com a não aprovação da importação da vacina e que esperava ouvir explicações dos representantes do laboratório.
“A polêmica é sobre a vacina russa e eu lamentei muito que os russos não entraram no debate, porque o Parlamento brasileiro precisa ouvir do Instituto Gamaleya, dos cientistas e técnicos russos os seus argumentos e dados”, disse.
O presidente do colegiado, deputado Luiz Antônio Teixeira Jr (PP-RJ), o Dr. Luizinho, reafirmou a possibilidade de revisão da decisão da Anvisa a partir do recebimento de mais informações da empresa.
“Nos próximos dias a Anvisa vai se debruçar sobre a vacina Sputnik. Tem que voltar à carga com os governadores do Nordeste para ver a documentação para que possa fazer uma liberação segura”, disse.
Instituto Gamaleya
O laboratório Gamaleya divulgou nota nesta terça-feira em que comentou a decisão da Anvisa. “A decisão da Agência Nacional de Vigilância Sanitária (Anvisa) de adiar a aprovação do Sputnik V é, infelizmente, de natureza política e nada tem a ver com o acesso da agência reguladora à informação ou à ciência. Em nossa opinião, esta decisão é consequência direta da pressão do Departamento de Saúde dos Estados Unidos, que em seu relatório anual de 2020, publicado há vários meses, declarou publicamente que órgão de saúde dos EUA ‘persuadiu o Brasil a rejeitar a vacina russa contra a covid-19’”.
Ainda conforme a nota, a decisão da Anvisa contradiz a decisão do Ministério da Ciência, Tecnologia e Inovação (MCTI), que reconheceu a vacina Sputnik V como segura e permitiu sua produção no Brasil. “A equipe do Sputnik V abordou as questões técnicas levantadas pelos conselheiros da Anvisa durante a reunião de 26 de abril para demonstrar que essas alegações não têm embasamento científico e não podem ser tratadas com seriedade na comunidade científica e entre os reguladores internacionais”, destaca a nota.
A aprovação da Comissão Técnica Nacional de Biossegurança (CTNBio), órgão ligado ao Ministério da Ciência, Tecnologia e Inovação, é condição para a inserção de qualquer organismo geneticamente modificado no mercado brasileiro, a exemplo de vacinas como a Sputinik V. Contudo, o uso do imunizante também depende de aprovação da Anvisa.
Com Agência Brasil